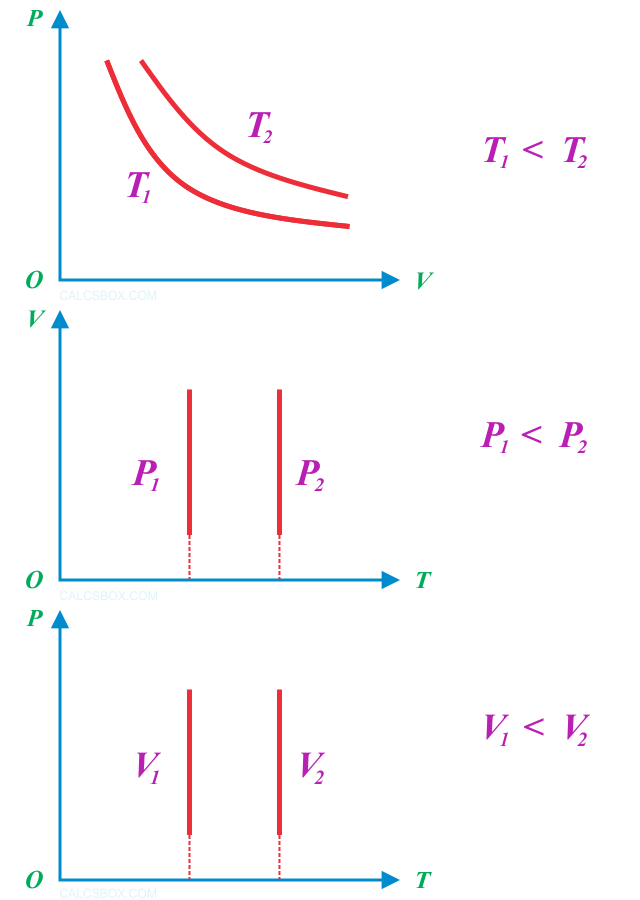
Закон Бойля-Мариотта. Изотерма
Первый газовый закон был открыт английским ученым Р. Бойлем в 1662 г. при исследовании упругости воздуха.
Между давлением и объемом данной массы газа при постоянной температуре существует обратная зависимость: p ~ 1 / V.
Немного позже, в 1676 году французский ученый Э. Мариотт независимо от Р. Бойля обобщенно сформулировал газовый закон, который теперь называют законом Бойля-Мариотта. По его утверждению, если при определенной температуре данная масса газа занимает объем V1 при давлении p1, а в другом состоянии при этой же температуре его давление и объем равняются p2 и V2, то справедливо соотношение:
p1 / p2 = V2 / V1 или p1V1 = p2V2.
Закон Бойля-Мариотта: если при постоянной температуре происходит термодинамический процесс, вследствие которого газ переходит из одного состояния (p1 и V1) в другое (p2 и V2), то произведение давления на объем данной массы газа при постоянной температуре является постоянным: pV = const.
где p — давление, V — объем, T — термодинамическая температура (изотермический процесс).
Закон Бойля-Мариотта устанавливает соотношение между давлением и объемом газа для изотермических процессов: при постоянной температуре объем V данной массы газа обратно пропорциональный его давлению P.
Термодинамический процесс, который происходит при постоянной температуре, называется изотермическим (от гр. isos — равный, therme — теплота). Графически на координатной плоскости pV он изображается гиперболой, которая называется изотермой . Разным температурам отвечают разные изотермы — чем выше температура, тем выше на координатной плоскости pV находится гипербола (T2>T1). Очевидно, что на координатной плоскости рТ и VT изотермы изображаются прямыми, перпендикулярными оси температур.
График изотермического процесса