Закон Гей-Люссака. Изобара
Открытие газового закона Р. Бойлем и Э. Мариоттом для изотермических процессов побудило ученых искать другие функциональные зависимости макропараметров газов. В 1802 году французский ученый Ж. Л. Гей-Люссак, исследуя зависимость объема газа от температуры при постоянном давлении, установил закон, названный со временем в его честь.
Закон Гей-Люссака Для данной массы газа отношение объема газа к его температуре постоянно, если давление газа не меняется.
Эту зависимость математически записывают так:
Данный закон приближенно можно наблюдать, когда происходит расширение газа при его нагревании в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня.
Другим проявлением закона Гей-Люссака в действии является аэростат. Закон Гей-Люссака не соблюдается в области низких температур, близких к температуре сжижения (конденсации) газов.
Закон справедлив для идеального газа. Он неплохо выполняется для разреженных газов, которые по своим свойствам близки к идеальному. Температура газа должна быть достаточно велика.
Обобщив экспериментальные данные, Гей-Люссак установил, что с изменением температуры при постоянном давлении относительный объем данной массы газа изменяется линейно.
На основании наблюдений он сформулировал утверждение, названное в его честь законом Гей-Люссака.
Закон Гей-Люссака При постоянном давлении относительное изменение объема газа данной массы прямо пропорционально изменению температуры:
где:
Δt — изменение температуры;
V — объем газа при определенной температуре t.
После некоторых математических преобразований, закон Гей-Люссака можно записать также в виде:
где:
V0 — объем газа при температуре t0.
Коэффициент пропорциональности α называется температурным коэффициентом объемного расширения. Расчета показали, что все разреженные газы при нагревании на 1°C или 1 K изменяют свой объем приблизительно на частицу от начального объема:
Гей-Люссак доказал, что у всех газов температурный коэффициент объемного расширения одинаковый и равен 1 / 273 K-1.
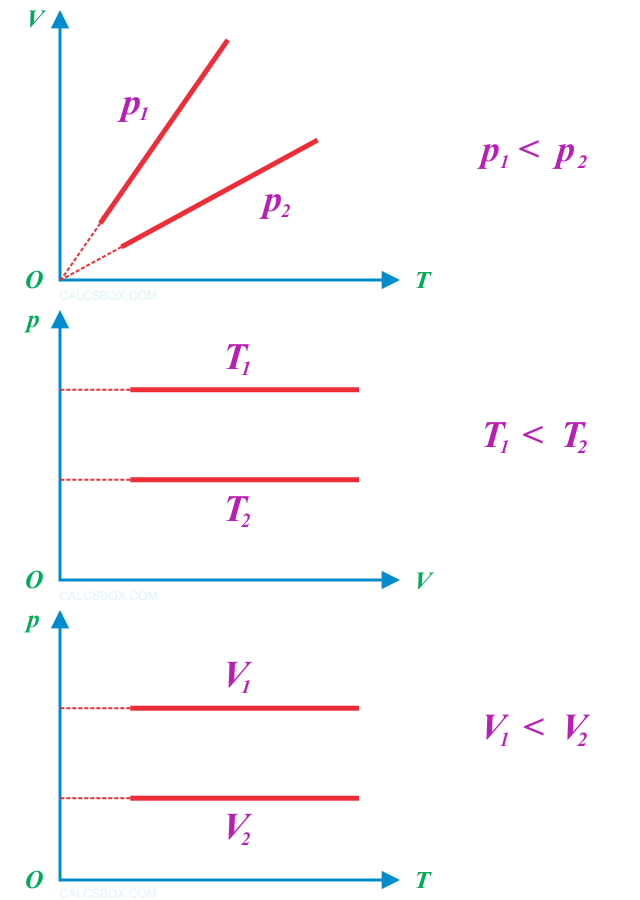
Термодинамический процесс, который происходит при постоянном давлении, называется изобарным, а линии, изображающие его, — изобарами. На координатной плоскости зависимости объема V от температуры t изобары будут иметь вид прямых, которые сходятся в одной точке. Их наклон зависит от значения давления — изобара, которая отвечает большему давлению, проходит ниже изобары меньшего давления (p1 < p2).
Закон Гей-Люссака приобретет более простую форму, если его выразить через абсолютную температуру. Поскольку 1 + αt = 1 + (1 / 273) • (T — 273) = αТ , то
V = V0αT.
Таким образом, при постоянном давлении объем данной массы газа прямо пропорциональный абсолютной температуре.
Закон Гей-Люссака утверждает, что в изобарном процессе отношение объемов данной массы газа в разных состояниях равно отношению абсолютных температур газа в этих состояниях:
Очевидно, что на координатных плоскостях pT и pV изобарами являются прямые, перпендикулярные оси давления.
График изобарного процесса