06-в. Количество теплоты и калориметр
§ 06-в. Количество теплоты и калориметр
В этом параграфе мы изучим несколько новых терминов. Определим их. Теплообмен — это явление перехода внутренней энергии одного тела во внутреннюю энергию другого тела без совершения механической работы. Количество теплоты — это энергия, перешедшая от одного тела к другому при теплообмене.
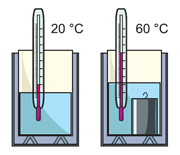
На рисунке показан калориметр — прибор для измерения количества теплоты. Простейший калориметр состоит из двух стаканов: внутреннего алюминиевого и внешнего пластмассового, которые разделены воздушным промежутком.
Рассмотрим пример. Во внутренний стакан нальём 100 г воды. Измерим её температуру: 20 °С. Погрузим в воду горячее тело — металлический цилиндрик. Внутри калориметра начнётся теплообмен, и некоторое количество теплоты перейдёт от цилиндрика к воде, в результате чего её температура повысится (см. рисунок). Вычислим изменение температуры воды:
Δt°воды = 60 °С — 20 °С = 40 °С .
Зная, что масса воды 100 г, инженер-теплотехник скажет: вода получила 100 г · 40 °С = 4000 калорий теплоты. В отличие от теплотехники, в физике количество теплоты выражают в джоулях (как и любую другую энергию). Для этого применяют специальную формулу:
Формула для подсчета количества теплоты, поглощаемого телом при нагревании или выделяющегося при его охлаждении. Формула читается так: «Ку равно цэ эм дэльта тэ».
| Q = c·m·Δt° |
Q — количество теплоты, Дж |
Удельная теплоёмкость вещества — физическая величина, показывающая количество теплоты, необходимое для изменения температуры 1 кг этого вещества на 1 °С.
Используя таблицу (см. далее), легко подсчитать, что вода внутри калориметра получила от цилиндрика 16,8 кДж теплоты:
Qводы = 4200 Дж/(кг°С) · 0,1 кг · 40 °С = 16800 Дж .
Формулу Q = cmΔt° применяют не только в том случае, когда вещество нагревается. Её также используют для подсчёта количества теплоты, которое отдают охлаждающиеся тела. Например, вода внутри отопительных батарей в квартире или классе.
Удельные теплоёмкости всех веществ измерены и занесены в специальные таблицы. Например, для воды в жидком состоянии с = 4200 Дж/(кг°С). Это значение показывает, что для нагревания 1 кг воды на 1 °С потребуется 4200 Дж теплоты. Можно сказать и иначе: каждый килограмм воды, остывая на 1 °С, отдаёт окружающим телам 4200 Дж тепловой энергии.
Удельная теплоемкость показывает количество теплоты, которое необходимо для нагревания 1 кг вещества на 1 градус. Или, что то же самое, — количество теплоты, которое выделится при охлаждении 1 кг этого вещества на 1 градус.
| Удельные теплоёмкости некоторых веществ, Дж/(кг°С) | ||||
| Алюминий | 920 | Вода | 4200 | |
| Железо | 460 | Лёд | 2100 | |
| Латунь | 400 | Масло подсолн. | 1700 | |
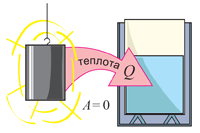
Поясним, почему в определении теплообмена присутствуют слова «без совершения механической работы». Вспомним, что в § 5-е мы рассмотрели опыт с манометром и горячей гирей. Тогда внутренняя энергия гири уменьшалась. Часть этой энергии превращалась в механическую работу — удлинялся «столбик» жидкости в манометре. В опыте с калориметром внутренняя энергия цилиндрика также уменьшалась. Однако теперь она превращалась во внутреннюю энергию воды без совершения работы (см. рисунок; для наглядности цилиндрик изображён вне калориметра).
Калориметрические измерения показывают, что теплообмен всегда протекает так, что убыль внутренней энергии одних тел сопровождается таким же приращением внутренней энергии других тел, участвующих в теплообмене. Это — одно из проявлений закона сохранения и превращения энергии.