14-й. Спектры и спектральный анализ
§ 14-й. Спектры и спектральный анализ
В предыдущем параграфе мы отметили, что белый свет можно разложить в спектр, в котором все цвета радуги плавно переходят друг в друга. Однако раскалённый металл даёт красно-оранжевый свет, а горящий природный газ — голубой. А бывает ли спектр у цветного света?
Опытами установлено: спектр раскалённого жидкого или твёрдого тела всегда непрерывный — сплошной. Различные его участки могут быть ярче или темнее, но обязательно присутствуют. Однако спектр раскалённого газообразного вещества всегда состоит из отдельных цветных полос. Их количество и расположение может быть различным (см. рисунок).

Такие спектры называют линейчатыми спектрами испускания. Линии в них расположены на определённых местах, соответствуя определённым длинам волн, а яркость линий не зависит от того, как возбуждается свечение: сильным нагреванием или, например, электричеством.
Если же через то же самое газообразное вещество пропустить белый свет, мы получим линейчатый спектр поглощения. Он примечателен тем, что места, где на спектре испускания мы ранее видели светлые полоски, станут чёрными, а места чёрных промежутков займут цветные части:

Опытами установлено: спектры испускания и спектры поглощения одного и того же вещества одинаковы с точки зрения расположения линий. Важно: речь идёт об одном и том же веществе в одном и том же состоянии. Например, водород в обычном газообразном состоянии (молекулярном), в ионизированном состоянии (под действием электрического тока или др.), в жидком состоянии (сжиженный газ) будут иметь различные спектры.
Чем более многоатомными становятся молекулы и чем больше плотность вещества, тем больше линий в спектре, тем больше он похож на сплошной. Однако примечательно то, что каждое вещество в каждом состоянии имеет характерный спектр. Это свойство позволяет обнаружить и распознать вещество, даже если его количество очень мало.
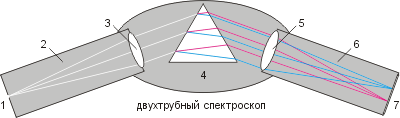
Для наблюдения спектров служит прибор спектроскоп (см. рисунок). Он состоит из двух труб: щелевой (2) и зрительной (6), а также округлой коробочки с треугольной призмой (4). Первая труба имеет щель (1), выделяющую узкую полоску изучаемого света, и линзу (3), направляющую лучи параллельно на призму. Вторая труба содержит линзу (5), позволяющую спроецировать спектр на матовый экран (7).
Применяя призмы из кварца или каменной соли, можно изучать спектральные линии не только в видимой, но и в инфракрасной и ультрафиолетовой частях спектра. Cпектроскопы используют для анализа выбрасываемых в атмосферу газов, состава полезных ископаемых, изучения небесных тел и во многих других случаях.

Зародившись в последней четверти XVII века, спектральный анализ дал физике огромное количество экспериментальных данных и поставил много вопросов, ответы на которые были даны только в XX веке. Вот несколько примеров. Почему твёрдые и жидкие вещества дают сплошные спектры, а газообразные — линейчатые? Почему у газов с одноатомными молекулами линии спектра более узкие, чем у газов с многоатомными? Почему линии спектра «расширяются», если газ сжать? Почему линии спектра каждого химического элемента всегда располагаются на определённых местах? Как возникает «холодный» люминесцентный свет газоразрядных трубок (см. фото) и тепловое излучение раскалённых тел? От чего зависит энергия, переносимая светом с различной длиной волны? И множество других.
На эти и другие вопросы ответы смогла дать только квантовая физика, к изучению которой мы приступаем в следующей теме.